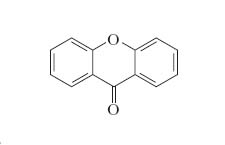
Lo xantone (nome sistematico: 9H-9-xantenone) è un composto organico eterociclico aromatico, la cui formula molecolare è C13H8O2.
In condizioni ambiente è un solido cristallino incolore, solubile in alcool, etere, benzene e cloroformio, ma molto poco in etere di petrolio.
Lo xantone è il capostipite di una famiglia di polifenoli eterociclici naturali, ma anche semisintetici o sintetici, noti come xantoni e che sono ampiamente diffusi nel regno vegetale. Diversi studi hanno dimostrato la loro attività come antiossidanti, antimicrobici, antinfiammatori, antiaggreganti piastrinici e antimalarici. Lo xantone è stato introdotto nel 1939 come insetticida e larvicida.
Etimologia
Il nome xantóne deriva dall'unione di «xant(ene)-» con il suffisso «-one»; «xant-» viene dal greco ξανθός (xanthós), di color giallo; «-one» è il suffisso generale usato per designare la presenza di un gruppo carbonilico (>C=O) nei chetoni.
Proprietà e struttura molecolare
Lo xantone è un composto termodinamicamente stabile, che si forma esotermicamente: ΔHƒ° = -196,8 ± 3,6 kJ/mol.
Lo xantone è una molecola planare, la sua simmetria appartiene al gruppo puntuale C2v.
Si forma dallo xantene, un etere diarilico, per ossidazione del metilene a ponte
>CH2 [O] → >C=O H2O)
ma può essere preparato per riscaldamento del salicilato di fenile.
Nella sua molecola sono presenti una funzione chetonica (chetone diarilico) e una eterea (etere diarilico), entrambe contenute nell'anello centrale non aromatico. Quest'ultimo ha la struttura del γ-pirone, dal quale lo xantone deriva per condensazione di due anelli benzenici, e da questo fatto viene l'altro suo nome di dibenzo-γ-pirone.
Tuttavia, il carbonile e l'ossigeno etereo, essendo connessi da un doppio legame C=C, formano nel loro insieme un lattone vinilogo, che è anche sede di una seconda forma di risonanza con separazione di carica; questa concorre ad accentuare la polarizzazione della densità elettronica verso l'ossigeno carbonilico, che è già presente in un carbonile non coniugato:
O−C=C−C=O ↔ O=C−C=C−O−
Infatti, lo xantone è un composto alquanto polare, il suo momento dipolare è μ = 2,99 D (1,86 D per l'acqua). Tuttavia, questa risonanza funziona al meglio nel γ-pirone tal quale, dove non c'è interferenza con gli anelli aromatici, presenti invece nello xantone. Il γ-pirone (p. fus. 33 °C) è infatti significativamente più polare (3,79 D).
Inoltre, la presenza dei due anelli benzenici, oltre a far aumentare di molto il punto di fusione dello xantone (176,4 °C), lo rende più idrofobico: la sua solubilità in acqua è molto bassa: 2,6 mg/L (1,3×10−5 M).
Note
Voci correlate
- Xantene
- Xantidrolo
- Tioxanteni
Altri progetti
- Wikimedia Commons contiene immagini o altri file su xantone